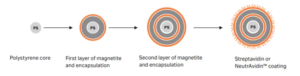
Introdução às esferas magnéticas de estreptavidina
Esferas magnéticas de estreptavidina (ESFERAS SA para abreviar) referem-se a microesferas magnéticas com substâncias bioativas específicas (estreptavidina) modificadas em sua superfície. As esferas magnéticas de estreptavidina são um tipo de esferas nanomagnéticas biológicas com um grupo funcional de superfície de estreptavidina. Elas podem se ligar especificamente a biotina ou moléculas marcadas com biotina, separando assim moléculas biotiniladas. A forte ligação e o efeito de amplificação multinível da avidina de biotina com reagentes de marcação dão a ela as vantagens de alta especificidade e sensibilidade, tornando-a amplamente usada em campos como detecção de ácido nucleico, purificação por afinidade, imunoensaio e separação de células.

A estreptomicina é uma proteína com características biológicas semelhantes à avidina. Ao contrário da avidina, que é encontrada na clara do ovo, a estreptavidina se origina do gênero Streptomyces e é um produto proteico secretado pela avidina do Streptomyces durante o cultivo. A SA também pode ser produzida por meio de engenharia genética. Uma molécula de estreptavidina se liga a quatro moléculas de biotina, e a interação entre as duas é uma das mais fortes forças de ligação não covalentes conhecidas na natureza.
A estreptomicina não contém cadeias laterais de glicosil em sua superfície, e seu ponto isoelétrico é mais próximo do neutro, o que é propício para reações biológicas. Portanto, sua sensibilidade e especificidade na detecção são maiores do que as da estreptavidina, tornando-a mais vantajosa em aplicações.
Além disso, há um tipo particularmente único de esfera magnética de afinidade neutra, que tem um ponto isoelétrico neutro e propriedades de desglicosilação, sem sequência de reconhecimento RYD. Portanto, sua ligação não específica é geralmente menor do que a da avidina e da estreptavidina, e mantém a mais alta atividade específica em relação às proteínas de ligação à biotina. As esferas magnéticas de afinidade neutra têm a menor ligação não específica e não reduzem a afinidade da biotina.
Aplicação de Estreptococoávidoem Contas Magnéticas
-
Quimioluminescência
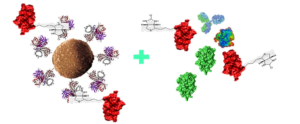
As esferas magnéticas de estreptavidina são muito fáceis de usar. Após a compra, elas são limpas e diluídas para se tornarem um componente do reagente luminescente. Ao misturar com anticorpos biotinilados para formar uma superfície de captura em fase sólida, a substância alvo na amostra pode ser capturada. As vantagens deste sistema, além da alta afinidade e efeito de amplificação mencionados anteriormente, são que os anticorpos biotinilados são simples e as moléculas de biotina são pequenas, e o acoplamento com antígenos/anticorpos não afeta a atividade da proteína.
Existem vários reagentes biotinilados disponíveis comercialmente, sendo os mais comumente usados moléculas biotiniladas contendo ésteres NHS, que dependem das cadeias laterais da biotina para formar vários grupos reativos que podem reagir e se ligar a outras moléculas (transportando amino, carboxila, tiol, etc.).
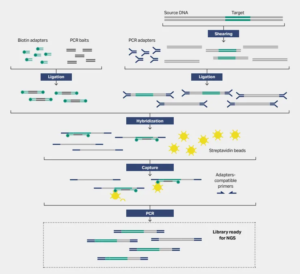
- Captura direcionada
O sequenciamento de captura direcionado é o processo de isolar e enriquecer genes alvo de todo o genoma e, em seguida, usar sequenciamento de alto rendimento (NGS), que é amplamente usado em triagem de saúde, testes clínicos e outras aplicações com alta sensibilidade. Atualmente, o sequenciamento de captura direcionado usa principalmente métodos de captura em fase líquida, onde sondas portadoras de biotina hibridizam com a região alvo e, em seguida, se ligam a esferas magnéticas de estreptavidina para obter a captura.
Outros fragmentos são lavados e, então, as sondas são separadas dos fragmentos alvo por desnaturação. A separação magnética remove as esferas magnéticas e as sondas vazias ligadas a elas, completando a captura da região alvo. As esferas magnéticas de estreptavidina são uma das matérias-primas importantes para a captura de hibridização em fase líquida.
-
Imunoprecipitação
Imunoprecipitação (IP) é um método clássico para estudar interações de proteínas com base na interação específica entre anticorpos e antígenos. Tratar uma proteína como um antígeno e usar anticorpos conhecidos contra ela para precipitá-la e separá-la de um sistema misto para obter extração e purificação preliminares é um método usado para separar e detectar proteínas específicas. Além das esferas magnéticas comuns de Proteína A ou Proteína G, as esferas magnéticas de estreptavidina também são uma opção, que requer apenas biotinilação de anticorpos antes da imunoprecipitação e, em seguida, separação e purificação usando esferas magnéticas de estreptavidina.
Ao mesmo tempo, as esferas magnéticas de estreptavidina são adequadas para todos os tipos de reações Pull down, especialmente para anticorpos que não podem se ligar à Proteína A/G, e são, portanto, amplamente utilizadas na preparação de amostras e no desenvolvimento de detecção para aplicações proteômicas. Além disso, devido à ligação não específica muito baixa das esferas magnéticas de estreptavidina, elas também podem ser usadas em análises de espectrometria de massa.
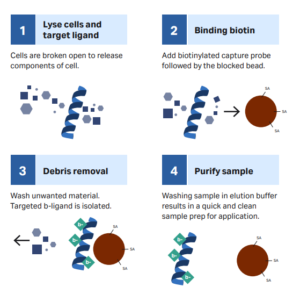
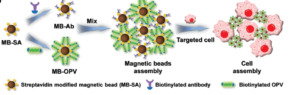
- Separação de células
Uma técnica que separa principalmente uma subpopulação específica de células de uma amostra de células mistas com base em suas características. Na análise clínica, seja biópsia de tecido ou coleta de sangue, a separação de células é uma etapa crítica porque amostras derivadas de pacientes produzem misturas complexas compostas de uma ampla gama de tipos de células, matrizes e fatores biológicos. Atualmente, a captura de analito baseada em esferas magnéticas se tornou um método amplamente utilizado na separação de células. Por meio de manipulação magnética simples, ela pode capturar populações de células-alvo altamente específicas.
Neste processo, os anticorpos são primeiro biotinilados, e as esferas magnéticas se ligam aos anticorpos biotinilados por meio da estreptavidina, alcançando a ligação específica aos antígenos correspondentes na superfície celular e capturando indiretamente as células por esferas magnéticas, alcançando assim a separação. As esferas magnéticas ideais não devem apenas facilitar a separação celular, mas também ser compatíveis com uma ampla gama de aplicações e análises posteriores.
O modo de ligação das esferas magnéticas de estreptavidina aos alvos:
De acordo com as diferentes moléculas alvo capturadas e aplicações posteriores, métodos diretos ou indiretos podem ser escolhidos para capturar moléculas alvo. O método direto é primeiro ligar o ligante biotinilado a esferas magnéticas de estreptavidina, então incubar com a amostra e, finalmente, capturar o alvo por meio de separação magnética.
Geralmente é adequado para detecção rápida de alvos. O método indireto envolve o ligante biotinilado primeiro se ligando à molécula alvo na amostra para formar um complexo, que é então co-incubado com esferas magnéticas de estreptavidina. Após a separação magnética, a molécula alvo é capturada. O método indireto é adequado para experimentos com baixa concentração de alvo, afinidade específica fraca ou cinética de ligação lenta, como aplicações de sequenciamento de captura direcionada NGS.
O SHBC pode fornecer esferas magnéticas de estreptavidina superparamagnéticas e de tamanho uniforme. A estreptavidina abundante na superfície pode se ligar eficientemente a moléculas biotiniladas, incluindo DNA, RNA, produtos de PCR, anticorpos, peptídeos e outras proteínas. Sob a ação de um campo magnético externo, as esferas magnéticas de estreptavidina são adsorvidas, separando-se assim de moléculas não alvo na amostra e alcançando a captura de moléculas alvo. Atualmente, as esferas magnéticas de estreptavidina são usadas principalmente em aplicações de pesquisa, como captura de ácido nucleico, separação de proteínas, classificação de células, imunoensaio e sequenciamento direcionado.

