История секвенирования отдельных клеток
Технология секвенирования отдельных клеток (SCS) относится к секвенированию генетической информации, переносимой клетками на уровне одной клетки, с целью получения последовательностей генов, транскриптов, белков и эпигенетической информации определенного типа клеток и проведения комплексного анализа. Он широко используется для идентификации новых видов, скрининга патогенов, эволюции патогенов, биологии развития, нейробиологии, исследования гетерогенности опухолей и циркулирующих опухолевых клеток [1-2]. В 2013 году технология секвенирования одиночных клеток была названа «Технологией года» по версии журнала Природные методы. В том же году, Наука поставил последовательность одиночных клеток на первое место в шести наиболее примечательных областях года.
С момента публикации первой исследовательской статьи по транскриптому отдельных клеток в 2009 году секвенирование отдельных клеток претерпело более десяти лет разработки. Благодаря постоянному совершенствованию различных технологий и появлению новых технологий, например, внедрение микрофлюидики, методов случайного захвата и штрих-кодов in-situ способствовало снижению стоимости реагентов и расходных материалов, а масштаб секвенирования увеличился. также увеличилась с ~ 100 клеток до сотен тысяч или даже миллионов клеток.
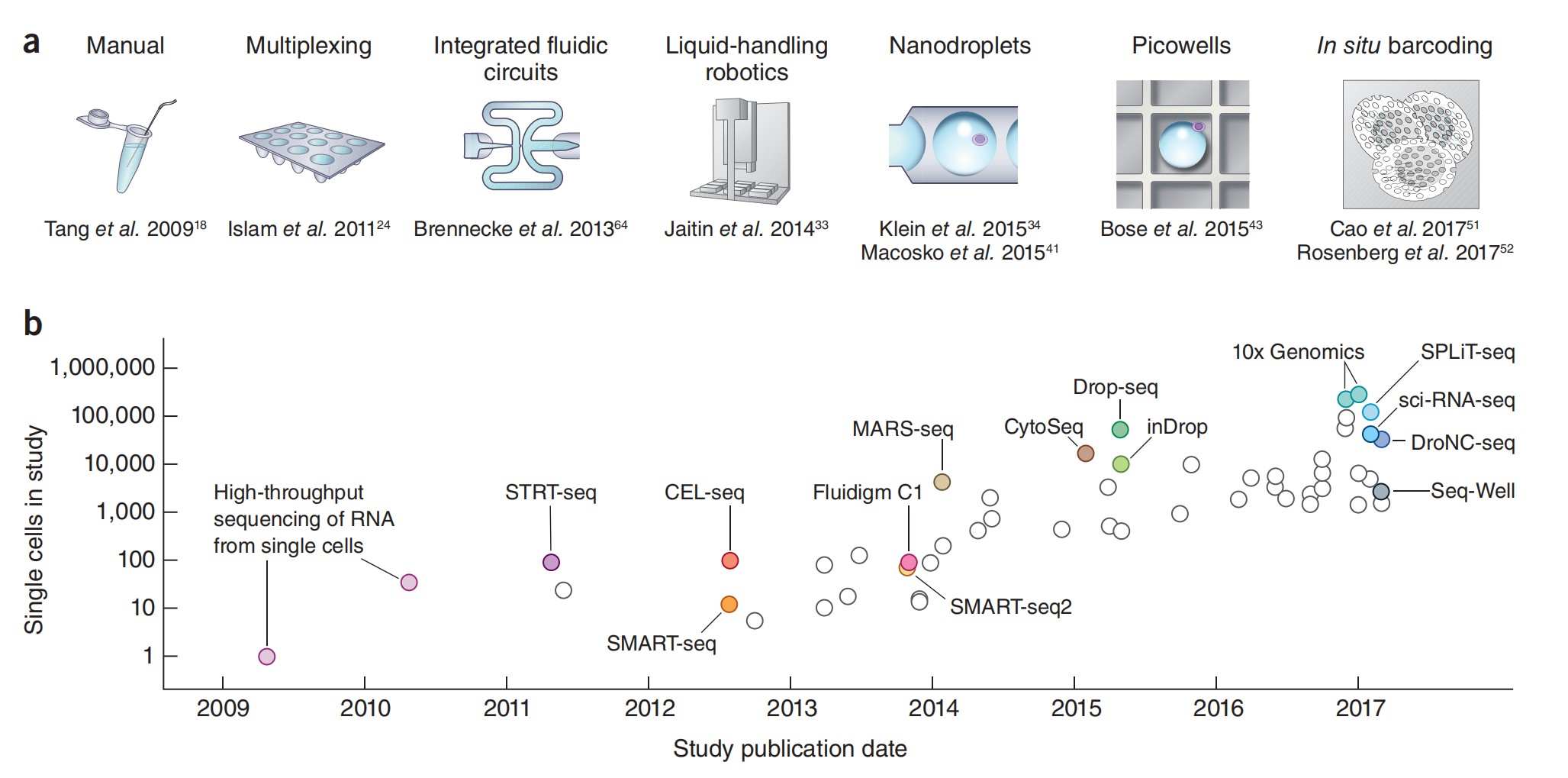
Рисунок 1: Масштабирование экспериментов по секРНК scRNA. (a) Ключевые технологии, которые позволили совершить скачок в масштабах экспериментов; (б) Номера клеток, указанные в репрезентативных публикациях по дате публикации [3].
Как добиться секвенирования на уровне клеток?
В организме человека около 40-60 триллионов клеток, а средний диаметр клеток составляет от 5 до 200 микрон. Чтобы секвенировать одну клетку, первая стратегия, которая приходит на ум, — это изолировать одну клетку, создать независимую библиотеку секвенирования и, наконец, выполнить секвенирование. Существует множество методов, которые можно использовать для точного манипулирования/разделения и анализа одиночных клеток, включая проточную цитометрию, микрофлюидные системы и различные методы разделения и обнаружения одиночных клеток в микромодульных системах.
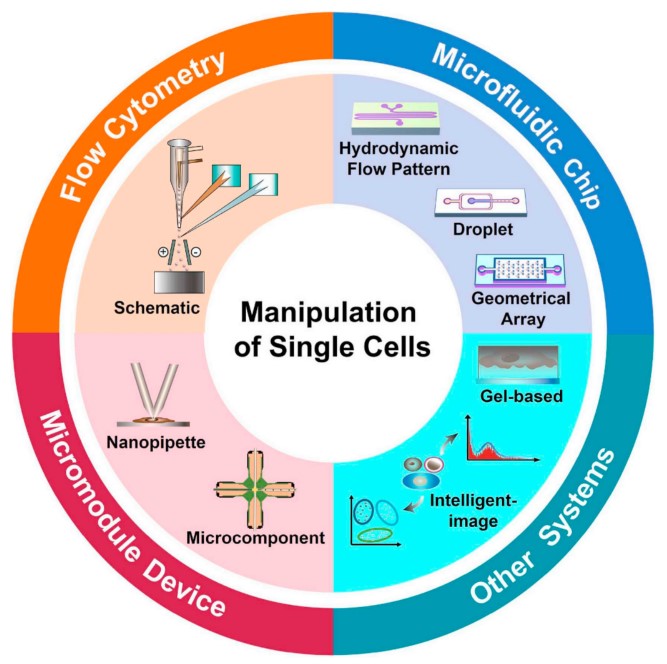
Рисунок 2: Классификация различных стратегий изоляции и манипулирования отдельными клетками[4].
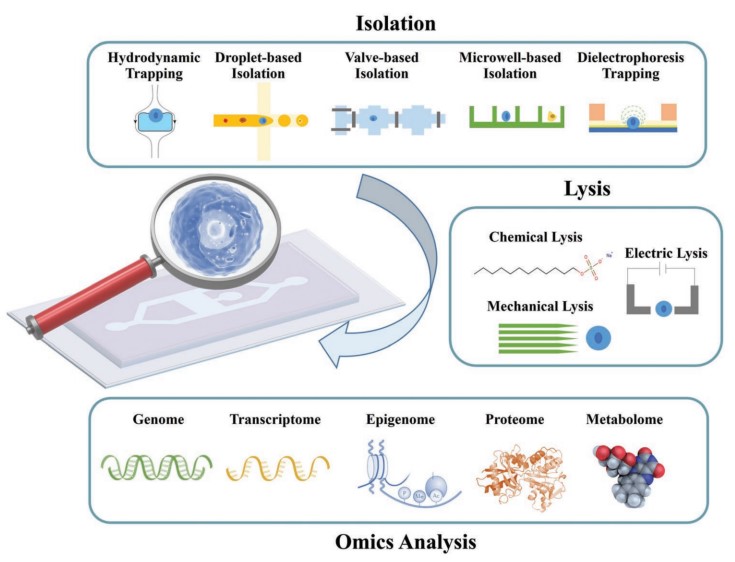
Рисунок 3: Схематическая иллюстрация микрофлюидного одноклеточного омического анализа [5].
Однако эта стратегия экономит образцы клеток, но высокая стоимость ограничивает увеличение производительности и ее широкое применение. В последние годы коммерческие платформы секвенирования одиночных клеток, такие как BD Rhapsody и 10X Genomics, внедрили идентификацию отдельных клеток на основе штрих-кода. Добавьте уникальный штрих-код последовательности ДНК к каждой клетке, и можно будет считать, что молекулы нуклеиновой кислоты, несущие одну и ту же последовательность ДНК, происходят из одной и той же клетки. Использование этой стратегии значительно упрощает процесс создания библиотеки секвенирования, и в одной библиотеке можно получить информацию о сотнях тысяч клеток.
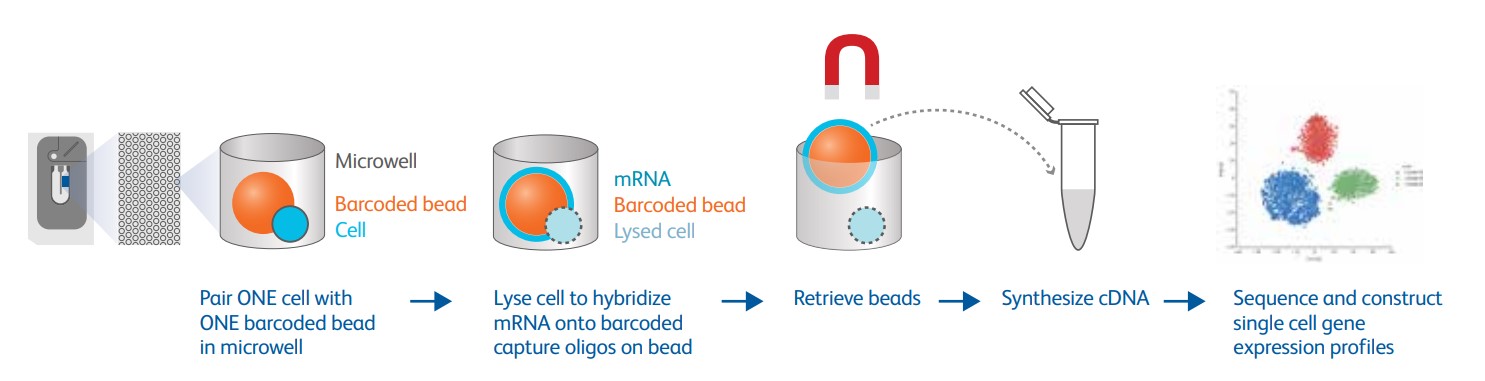
Рис. 4. Рабочий процесс BD Rhapsody: одна микролунка = одна клетка = одна магнитная бусина = одна секвенирование РНК (с официального сайта BD).
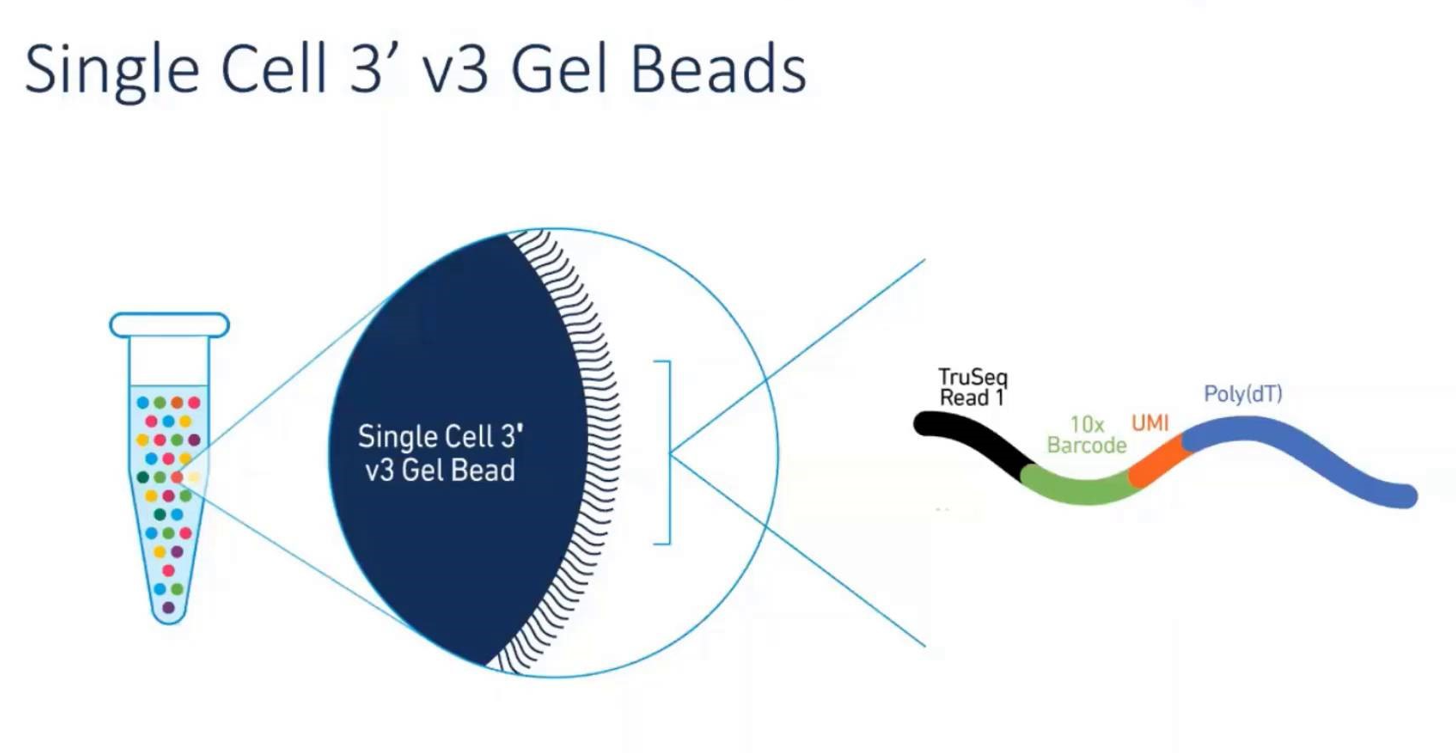
Рисунок 5: Рабочий процесс 10X Genomics: одна капля масла = одна клетка = один шарик геля = один секвенирование РНК (с официального сайта 10X Genomics).

