Введение в магнитные шарики стрептавидина
Стрептавидиновые магнитные шарики (SA-бусины для краткости) относятся к магнитным микросферам с определенными биоактивными веществами (стрептавидином), модифицированными на их поверхности. Стрептавидиновые магнитные бусины представляют собой тип биологических наномагнитных бус с поверхностной функциональной группой стрептавидина. Они могут специфически связываться с биотином или молекулами, мечеными биотином, тем самым разделяя биотинилированные молекулы. Сильное связывание и многоуровневый эффект усиления биотин-авидина с маркирующими реагентами дают ему преимущества высокой специфичности и чувствительности, что делает его широко используемым в таких областях, как обнаружение нуклеиновых кислот, аффинная очистка, иммуноанализ и разделение клеток.

Стрептомицин — это белок с биологическими характеристиками, схожими с авидином. В отличие от авидина, который содержится в яичном белке, стрептавидин происходит из рода Streptomyces и является белковым продуктом, секретируемым Streptomyces avidin во время культивирования. SA также может быть получен с помощью генной инженерии. Одна молекула стрептавидина связывается с четырьмя молекулами биотина, и взаимодействие между ними является одной из самых сильных нековалентных связывающих сил, известных в природе.
Стрептомицин не содержит гликозильных боковых цепей на своей поверхности, а его изоэлектрическая точка ближе к нейтральной, что благоприятствует биологическим реакциям. Поэтому его чувствительность и специфичность обнаружения выше, чем у стрептавидина, что делает его более выгодным в приложениях.
Кроме того, существует уникальный тип нейтральной аффинной магнитной бусины, которая имеет нейтральную изоэлектрическую точку и свойства дегликозилирования, без последовательности распознавания RYD. Поэтому ее неспецифическое связывание обычно ниже, чем у авидина и стрептавидина, и она сохраняет самую высокую специфическую активность по отношению к биотинсвязывающим белкам. Нейтральные аффинные магнитные бусины имеют самое низкое неспецифическое связывание и не снижают сродство к биотину.
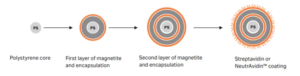
Применение Стрептококкжадныйв Магнитных Бусинах
-
Хемилюминесценция
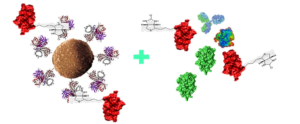
Магнитные шарики стрептавидина очень просты в использовании. После покупки их очищают и разбавляют, чтобы они стали компонентом люминесцентного реагента. Смешивая с биотинилированными антителами для образования твердофазной поверхности захвата, можно захватить целевое вещество в образце. Преимущества этой системы, в дополнение к высокому сродству и эффекту амплификации, упомянутому ранее, заключаются в том, что биотинилированные антитела просты, а молекулы биотина малы, а связывание с антигенами/антителами не влияет на активность белка.
Существуют различные коммерчески доступные биотинилированные реагенты, наиболее часто используемые из которых представляют собой биотинилированные молекулы, содержащие эфиры NHS, которые используют боковые цепи биотина для образования различных реактивных групп, которые могут реагировать и связываться с другими молекулами (несущими амино, карбоксильные, тиоловые и т. д.).
- Целенаправленный захват
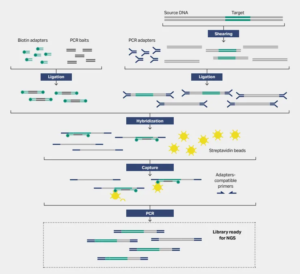
Целевое секвенирование захвата — это процесс выделения и обогащения целевых генов из всего генома, а затем использование высокопроизводительного секвенирования (NGS), которое широко используется в скрининге здоровья, клинических испытаниях и других приложениях с высокой чувствительностью. В настоящее время целевое секвенирование захвата в основном использует методы захвата в жидкой фазе, где зонды, несущие биотин, гибридизуются с целевой областью, а затем связываются со стрептавидиновыми магнитными шариками для достижения захвата.
Другие фрагменты смываются, а затем зонды отделяются от целевых фрагментов путем денатурации. Магнитное разделение удаляет магнитные бусины и пустые зонды, связанные с ними, завершая захват целевой области. Стрептавидиновые магнитные бусины являются одним из важных исходных материалов для захвата методом гибридизации в жидкой фазе.
-
Иммунопреципитация
Иммунопреципитация (ИП) — классический метод изучения взаимодействия белков, основанный на специфическом взаимодействии между антителами и антигенами. Обработка белка как антигена и использование известных антител против него для его осаждения и отделения от смешанной системы для достижения предварительной экстракции и очистки — это метод, используемый для разделения и обнаружения специфических белков. В дополнение к обычным магнитным шарикам Protein A или Protein G, магнитные шарики стрептавидина также являются вариантом, для которого требуется только биотинилирование антител перед иммунопреципитацией, а затем разделение и очистка с использованием магнитных шариков стрептавидина.
В то же время магнитные шарики стрептавидина подходят для всех типов реакций Pull down, особенно для антител, которые не могут связываться с белком A/G, и поэтому широко используются при подготовке образцов и разработке детектирования для приложений протеомики. Кроме того, из-за очень низкого неспецифического связывания магнитных шариков стрептавидина их также можно использовать в масс-спектрометрическом анализе.
- Разделение клеток
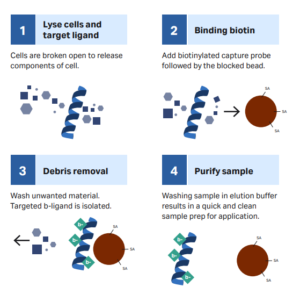
Метод, который в первую очередь отделяет определенную субпопуляцию клеток от смешанного образца клеток на основе их характеристик. В клиническом анализе, будь то биопсия ткани или забор крови, разделение клеток является критически важным шагом, поскольку образцы, полученные от пациентов, производят сложные смеси, состоящие из широкого спектра типов клеток, матриц и биологических факторов. В настоящее время захват аналита на основе магнитных шариков стал широко используемым методом разделения клеток. С помощью простых магнитных манипуляций он может высокоспецифично захватывать целевые популяции клеток.
В этом процессе антитела сначала биотинилируются, а магнитные шарики связываются с биотинилированными антителами через стрептавидин, достигая специфического связывания с соответствующими антигенами на поверхности клетки и косвенно захватывая клетки магнитными шариками, таким образом достигая разделения. Идеальные магнитные шарики должны не только облегчать разделение клеток, но и быть совместимыми с широким спектром последующих приложений и анализов.
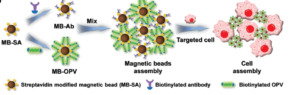
Режим связывания магнитных частиц стрептавидина с мишенями:
В зависимости от различных целевых молекул, захваченных и последующих применений, можно выбрать прямые или косвенные методы для захвата целевых молекул. Прямой метод заключается в том, чтобы сначала связать биотинилированный лиганд с магнитными шариками стрептавидина, затем инкубировать с образцом и, наконец, захватить цель посредством магнитного разделения.
Обычно он подходит для быстрого обнаружения целей. Непрямой метод включает в себя связывание биотинилированного лиганда с целевой молекулой в образце для образования комплекса, который затем ко-инкубируется с магнитными шариками стрептавидина. После магнитного разделения целевая молекула захватывается. Непрямой метод подходит для экспериментов с низкой концентрацией цели, слабым специфическим сродством или медленной кинетикой связывания, например, для приложений целевого захвата NGS.
SHBC может предоставить однородного размера и суперпарамагнитные стрептавидиновые магнитные шарики. Обильный стрептавидин на поверхности может эффективно связываться с биотинилированными молекулами, включая ДНК, РНК, продукты ПЦР, антитела, пептиды и другие белки. Под действием внешнего магнитного поля стрептавидиновые магнитные шарики адсорбируются, тем самым отделяясь от нецелевых молекул в образце и достигая захвата целевых молекул. В настоящее время стрептавидиновые магнитные шарики в основном используются в исследовательских приложениях, таких как захват нуклеиновых кислот, разделение белков, сортировка клеток, иммуноанализ и целевое секвенирование.

